XBB対応ワクチンは臨床試験なしで承認したらしい
無理に接種を勧める状況ではないそうです。
産経新聞(2023/7/26)接種は「個人判断の時期」 コロナワクチンで日医
日本医師会の釜萢敏常任理事は26日、東京都内での記者会見で、新型コロナウイルスのワクチン接種に関し「全体の感染を抑えるために予防接種をするというより、個人の視点から選択してもらう時期に入った」と述べた。接種後に体調不良を訴える人がいることを踏まえた。
釜萢氏は、ワクチンの有効性を改めて説明した上で、高齢者や基礎疾患のある人以外では重症化のリスクが低い状況を指摘。「接種後に体調を崩してつらい思いをしたという人に対して、無理に接種を勧める状況では徐々になくなっているのではないか」と語った。
「接種後に体調不良を訴える人」
「接種後に体調を崩してつらい思いをしたという人」
医療現場でそのような人がどんどん増えるのを目の当たりにして、さすがにもうこれ以上、打て打てキャンペーンはできないと思ったのでしょうか。
今回のXBB対応ワクチンですが、臨床試験をやっていないのに承認したというのが少し気になります。
厚労省の審査結果にはこのように記載されています。
第50回厚生科学審議会予防接種・ワクチン分科会 資料1価(オミクロン株XBB.1.5系統)のコロナワクチンの審査結果について(コミナティRTU筋注等)
2 審査方針
国際的な評価の考え方と、これまでの臨床試験成績や使用実績を踏まえると、ファイザー社の1価(オミクロン株 XBB.1.5 系統)ワクチンについては、品質において問題がないこと、非臨床試験でオミクロン株(XBB.1.5 系統を含む)に対して中和抗体価が上昇していることを確認すること、必要に応じて製造販売後に有効性・安全性の確認を行うことにより、承認して差し支えないかどうかの判断をすることとしたい。
この審査方針は、ICMRAの会議で決まったやり方だそうです。
第50回厚生科学審議会予防接種・ワクチン分科会 資料新変異株対応のコロナワクチンの評価方針について
令和5年5月8日に開催されたICMRAのCOVID-19変異株ワークショップにおいては、現在承認されているワクチンについてはプラットフォームとしての対応が適応可能であり、そのような場合は、株変更に際して、確認的な品質及び非臨床データのみの資料提出でよいとの見解がまとめられている。〇ファイザー社及びモデルナ社の起源株1価ワクチンとオミクロン株2価ワクチンの安全性については、これまで実施されてきた臨床試験における安全性に係るデータや使用実績(接種後の副反応の発現状況等)から、起源株1価ワクチンとオミクロン株2価ワクチンの安全性プロファイルには大きな差が無いことが確認されている。
〇上記を踏まえると、1価/2価の違い、起源株/オミクロン株の違いはワクチンの安全性プロファイルに大きな影響を及ぼさないと考えられる。
〇従って、オミクロン株1価ワクチンの安全性プロファイルも既承認の製剤の安全性プロファイルと基本的には同様であり、安全性に特段の懸念はないものと予見することは可能である。〇株の違いによる遺伝子配列の違いを除き、起源株1価ワクチンで既に検証された製造方法及び規格試験の変更はなく、実際に製造されたオミクロン株1価ワクチンについて起源株1価ワクチン等と同等の品質のものが同様に製造されていることを確認する。
ICMRAのワークショップの内容はここにあります。
ICMRA COVID-19 Omicron variant workshop
今までのワクチンとは株が少し違うだけで製造方法も同じだから、臨床試験はしなくても大丈夫でしょう。
という考えのようです。
FDAのニュースリリースにはこう書かれています。
FDA Takes Action on Updated mRNA COVID-19 Vaccines to Better Protect Against Currently Circulating VariantsThe mRNA COVID-19 vaccines approved and authorized today are supported by the FDA’s evaluation of manufacturing data to support the change to the 2023-2024 formula and non-clinical immune response data on the updated formulations including the XBB.1.5 component.
本日承認・認可されたmRNA COVID-19ワクチンは、2023~2024年の処方変更を裏付ける製造データと、XBB.1.5成分を含む更新された処方に関する非臨床免疫応答データのFDAの評価によって裏付けられている。
non-clinical immune response data
「非臨床の免疫応答データ」
要するにマウスのデータで効果を確認したということです。
ファイザーの資料の下の端に小さく
N=10 mice per vaccine group
と書かれています。
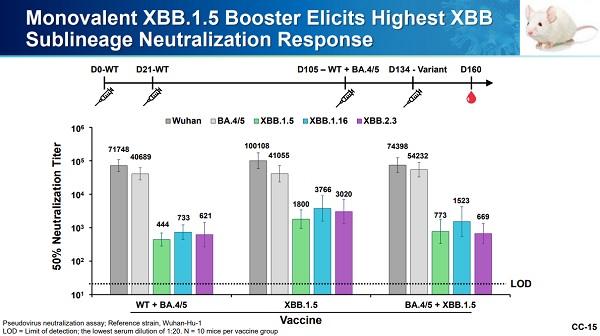
[FDA] Pfizer: 2023-2024 COVID19 Vaccine Formula- Clinical and Preclinical Supportive Data
モデルナは一応マウスと人間の両方で試験しているようです。
上がマウスの試験結果、下が人間の試験結果です。
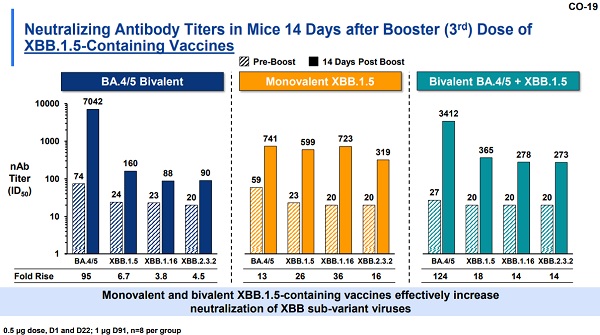
[FDA] Moderna: COVID19 Variant Vaccines
モデルナのXBB.1.5の接種前後の中和抗体価は、マウスは26倍、人間は16倍で、抗体価の値もマウスと人間で結構違うようですが、ファイザーは本当に人間でやらなくていいのでしょうか?
ちなみに、ファイザーのXBBワクチンの審査結果
にこのように書かれています。
ファイザー社の1価(オミクロン株 XBB.1.5 系統)ワクチンについて、ウイルス株の違いによる遺伝子配列の違いを除き、1価(起源株)ワクチンで既に検証された製造方法及び規格試験により、1価(起源株)ワクチン等と同等の品質の原薬及び製剤が製造されていることを確認した。
最初の武漢株用の時から品質が同じということは、品質の改善もされていないということでしょうか。
そうだとすると、この傾向もそのままの可能性があります。
Batch-dependent safety of the BNT162b2 mRNA COVID-19 vaccineBNT162b2 mRNA COVID-19 ワクチンのバッチ依存の安全性
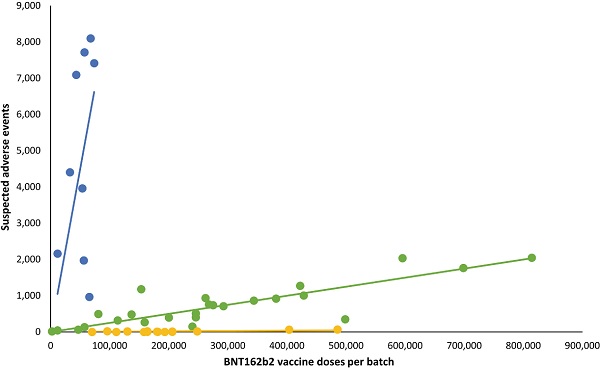
デンマークにおけるBNT612b2 mRNAワクチン接種後(2020年12月27日~2022年1月11日)に疑われる有害事象(SAE)の数を、ワクチンバッチごとの投与数別に示したもの。各ドットは単一のワクチン バッチを表します。
青、緑、黄色のトレンドラインを表すワクチンバッチは、すべてのワクチン接種の4.22%、63.69%、32.09%です。
黄色ラインのロットはよく分かりませんが、青ラインのロットは不良品の可能性が高いと思います。
ワクチンの製造品質が今もこの時と同等だとすると、今でも不良品が同等レベルで発生している可能性があります。
ロシアンルーレットは今後も続くことになります・・